1
Department of Molecular Biosciences, The Wenner–Gren Institute, Stockholm University, SE-10691 Stockholm, Sweden
2
Department of Clinical Microbiology, Virology, Umeå University, SE-90185 Umeå, Sweden
Το σοβαρό οξύ αναπνευστικό σύνδρομο κοροναϊός 2 (SARS–CoV–2) είναι υπεύθυνος για τη συνεχιζόμενη πανδημία της νόσου του κορωνοϊού 2019 (COVID–19) που έχει οδηγήσει σε περισσότερους από 2,3 εκατομμύρια θανάτους. Ο SARS-CoV-2 είναι ένας περικαλυμμένος ιός RNA θετικής αίσθησης που αποτελείται από δομικές και μη δομικές πρωτεΐνες [ 1 ]. Μετά τη μόλυνση, αυτές οι ιικές πρωτεΐνες καταλαμβάνουν και απορυθμίζουν τον κυτταρικό μηχανισμό του ξενιστή για να αναπαραχθούν, να συναρμολογηθούν και να διαδοθούν οι απογονικοί ιοί [ 2 ]. Πρόσφατες κλινικές μελέτες έχουν δείξει ότι η λοίμωξη από SARS-CoV-2 επηρεάζει εξαιρετικά τον αριθμό και τη λειτουργία των λεμφοκυττάρων [ 3 , 4 , 5 , 6]. Σε σύγκριση με τους ήπιους και μέτριους επιζώντες, οι ασθενείς με σοβαρό COVID-19 εμφανίζουν σημαντικά χαμηλότερο αριθμό ολικών Τ κυττάρων, βοηθητικών Τ κυττάρων και κατασταλτικών Τ κυττάρων [ 3 , 4 ]. Επιπλέον, ο COVID-19 καθυστερεί τα επίπεδα IgG και IgM μετά την έναρξη των συμπτωμάτων [ 5 , 6 ]. Συλλογικά, αυτές οι κλινικές παρατηρήσεις υποδηλώνουν ότι ο SARS-CoV-2 επηρεάζει το προσαρμοστικό ανοσοποιητικό σύστημα. Ωστόσο, ο μηχανισμός με τον οποίο ο SARS-CoV-2 καταστέλλει την προσαρμοστική ανοσία παραμένει ασαφής.
Ως δύο κρίσιμα συστήματα επιτήρησης του ξενιστή, το ανοσοποιητικό σύστημα και το σύστημα επιδιόρθωσης DNA είναι τα κύρια συστήματα στα οποία βασίζονται οι ανώτεροι οργανισμοί για την άμυνα έναντι διαφόρων απειλών και την ομοιόσταση των ιστών. Αναδυόμενα στοιχεία δείχνουν ότι αυτά τα δύο συστήματα αλληλοεξαρτώνται, ειδικά κατά την ανάπτυξη και την ωρίμανση των λεμφοκυττάρων [ 7 ]. Ως μία από τις κύριες οδούς επιδιόρθωσης θραύσης διπλού κλώνου DNA (DSB), η επιδιόρθωση μη ομόλογης σύνδεσης άκρου (NHEJ) διαδραματίζει κρίσιμο ρόλο στον ανασυνδυασμό V(D)J που προκαλείται από τον ειδικό ανασυνδυασμό των λεμφοκυττάρων (RAG). το οποίο έχει ως αποτέλεσμα ένα εξαιρετικά ποικιλόμορφο ρεπερτόριο αντισωμάτων σε Β-λεμφοκύτταρα και υποδοχείς Τ-λεμφοκυττάρων (TCRs) στα Τ κύτταρα [ 8]. Για παράδειγμα, η απώλεια λειτουργίας βασικών πρωτεϊνών επιδιόρθωσης του DNA όπως ATM, DNA-PKcs, 53BP1, et al., οδηγεί σε ελαττώματα στην επιδιόρθωση του NHEJ που αναστέλλουν την παραγωγή λειτουργικών Β και Τ κυττάρων, οδηγώντας σε ανοσοανεπάρκεια [ 7 , 9 , 10 , 11 ]. Αντίθετα, η ιογενής λοίμωξη προκαλεί συνήθως βλάβη στο DNA μέσω διαφορετικών μηχανισμών, όπως η πρόκληση παραγωγής αντιδραστικών ειδών οξυγόνου (ROS) και το στρες αντιγραφής του κυττάρου ξενιστή [ 12 , 13 , 14]. Εάν η βλάβη του DNA δεν μπορεί να επιδιορθωθεί σωστά, θα συμβάλει στην ενίσχυση της παθολογίας που προκαλείται από ιογενείς λοιμώξεις. Ως εκ τούτου, στοχεύσαμε να διερευνήσουμε εάν οι πρωτεΐνες SARS-CoV-2 παραβιάζουν το σύστημα αποκατάστασης βλάβης του DNA, επηρεάζοντας έτσι την προσαρμοστική ανοσία in vitro.
2. Υλικά και μέθοδοι
2.1. Αντισώματα και Αντιδραστήρια
ΫΑΡΙ (Cat # MBD0015), δοξορουβικίνη (Cat # D1515), H 2 O 2 (Cat # Η1009), και τα αντισώματα β-τουμπουλίνης (Cat # T4026) αγοράστηκαν από την Sigma-Aldrich. Αντισώματα κατά της ετικέτας His (Cat #12698), H2A (Cat #12349), H2A.X (Cat #7631), γ–H2A.X (Cat #2577), Ku80 (Cat # 2753) και Rad51 (Cat #8875 ) αγοράστηκαν από την Cell Signaling Technology (Danvers, MA, ΗΠΑ). Τα αντισώματα 53BP1 (Cat #NB100-304) και RNF168 (Cat #H00165918–M01) ελήφθησαν από τη Novus Biologicals (Novus Biologicals, Littleton, CO, USA). Αντισώματα Lamin B (Cat #sc–374015), ATM (Cat #sc–135663), DNA–PK (Cat #sc–5282) και BRCA1 (Cat #sc–28383) αγοράστηκαν από την Santa Cruz Biotechnology (Santa Cruz, CA, ΗΠΑ). Το αντίσωμα XRCC4 (Cat #PA5-82264) αγοράστηκε από την Thermo Fisher Scientific (Waltham, ΜΑ, ΗΠΑ).
2.2. Πλασμίδια
Τα pHPRT–DRGFP και pCBASceI δόθηκαν ευγενικά από τη Maria Jasin (Addgene πλασμίδια #26476 και #26477) [ 15 ]. Το pimEJ5GFP ήταν ένα δώρο από τον Jeremy Stark (Addgene πλασμίδιο #44026) [ 16]. Οι πρωτεΐνες NSP1, NSP9, NSP13, NSP14, NSP16, spike και νουκλεοκαψιδικών πρωτεϊνών αρχικά συντέθηκαν με βελτιστοποίηση κωδικονίων και στη συνέχεια κλωνοποιήθηκαν σε φορέα έκφρασης θηλαστικού pUC57 με C-τελική ετικέτα 6xHis. Μια ανεστραμμένη συμπληρωματική αλληλουχία RSS-GFP 12-διαχωριστών-ένα RSS 23-διαστήματος συντέθηκε για το διάνυσμα αναφοράς V(D)J. Στη συνέχεια, η αλληλουχία κλωνοποιήθηκε στον φορέα pBabe–IRES–mRFP για να δημιουργηθεί ο φορέας αναφοράς pBabe–12RSS–GFPi–23RSS–IRES–mRFP. 12–ακολουθία RSS διαστήματος: 5′–CACAGTGCTACAGACTGGAACAAAAACC–3′. 23–αλληλουχία RSS διαστήματος: 5′–CACAGTGGTAGTACTCACTGTCTGGCTGTACAAAAACC–3′. Τα κατασκευάσματα έκφρασης RAG1 και RAG2 δόθηκαν γενναιόδωρα από τον Martin Gellert (πλασμίδιο Addgene #13328 και #13329) [ 17 ].
2.3. Κύτταρα και Κυτταρική Καλλιέργεια
ΗΕΚ293Τ και ΗΕΚ293 κύτταρα που ελήφθησαν από την American Type Culture Collection (ATCC) καλλιεργήθηκαν κάτω από 5% CO 2 στους 37 ° C σε τροποποιημένο μέσο Eagle του Dulbecco (ϋΜΕΜ, υψηλής γλυκόζης, GlutaMAX) (Life Technologies, Carlsbad, CA, USA) που περιέχει 10 % ( v / v ) ορός εμβρύου μόσχου (FCS, Gibco), 1% ( v / v ) πενικιλίνη (100 IU/mL) και στρεπτομυκίνη (100 μg/mL). Τα κύτταρα αναφοράς HEK293T–DR–GFP και HEK293T–EJ5–GFP δημιουργήθηκαν όπως περιγράφηκε προηγουμένως και καλλιεργήθηκαν υπό 5% CO 2 στους 37 °C στο προαναφερθέν μέσο καλλιέργειας.
2.4. HR και NHEJ Reporter Assays
Η επισκευή HR και NHEJ σε κύτταρα HEK293T μετρήθηκαν όπως περιγράφηκε προηγουμένως χρησιμοποιώντας σταθερά κύτταρα DR-GFP και EJ5-GFP. Εν συντομία, 0,5 × 10 6 σταθερά κύτταρα αναφοράς HEK293T σπάρθηκαν σε πλάκες 6 φρεατίων και επιμολύνθηκαν με πλασμίδιο έκφρασης 2 μg I-SceI (pCBASceI) μαζί με πλασμίδια έκφρασης πρωτεϊνών SARS-CoV-2. Σαράντα οκτώ ώρες μετά τη διαμόλυνση και τη θεραπεία με ασπιρίνη, τα κύτταρα συλλέχθηκαν και αναλύθηκαν με ανάλυση κυτταρομετρίας ροής για έκφραση GFP. Τα μέσα λήφθηκαν από τρία ανεξάρτητα πειράματα.
2.5. Κυτταρική κλασμάτωση και ανοσοστύπωση
Για τον προσδιορισμό κυτταρικού κλάσματος, χρησιμοποιήθηκε το κιτ υποκυτταρικής κλασματοποίησης πρωτεΐνης (Thermo Fisher) σύμφωνα με τις οδηγίες του κατασκευαστή. Τα προϊόντα λύσης πρωτεΐνης ποσοτικοποιήθηκαν χρησιμοποιώντας το αντιδραστήριο BCA (Thermo Fisher Scientific, Rockford, IL, USA). Οι πρωτεΐνες αναλύθηκαν με ηλεκτροφόρηση γέλης δωδεκυλοθειικού νατρίου-πολυακρυλαμιδίου (SDS-PAGE), μεταφέρθηκαν σε μεμβράνες νιτροκυτταρίνης (Amersham protran, 0,45 μm NC) και ανοσοστυπώθηκαν με συγκεκριμένα πρωτογενή αντισώματα ακολουθούμενα από συζευγμένα με HRP δευτερογενή αντισώματα. Οι ζώνες πρωτεΐνης ανιχνεύθηκαν χρησιμοποιώντας κιτ SuperSignal West Pico ή Femto Chemiluminescence (Thermo Fisher Scientific).
2.6. Comet Assay
Τα κύτταρα υποβλήθηκαν σε επεξεργασία με διαφορετικά αντιδραστήρια βλάβης του DNA και στη συνέχεια συλλέχθηκαν στα υποδεικνυόμενα χρονικά σημεία για ανάλυση. Κύτταρα (1 × 10 5κύτταρα/mL σε ψυχρό αλατούχο διάλυμα ρυθμισμένο με φωσφορικά [PBS]) επαναιωρήθηκαν σε αγαρόζη 1% χαμηλής τήξης στους 40 °C σε αναλογία 1:3 vol/vol και μεταφέρθηκαν με πιπέτα σε CometSlide. Οι αντικειμενοφόρες πλάκες μετά βυθίστηκαν σε προψυγμένο ρυθμιστικό λύσης (1,2 Μ NaCl, 100 mM EDTA, 0,1% λαυρυλοσαρκοσινικό νάτριο, 0,26 Μ NaOH pH > 13) για ολονύκτια (18-20 ώρες) λύση στους 4 °C στο σκοτάδι. Οι αντικειμενοφόρες πλάκες στη συνέχεια αφαιρέθηκαν προσεκτικά και βυθίστηκαν σε ρυθμιστικό διάλυμα έκπλυσης (0,03 Μ NaOH και 2 mM EDTA, ρΗ > 12) σε θερμοκρασία δωματίου (RT) για 20 λεπτά στο σκοτάδι. Αυτό το βήμα πλύσης επαναλήφθηκε δύο φορές. Οι αντικειμενοφόρες πλάκες μεταφέρθηκαν σε οριζόντιο θάλαμο ηλεκτροφόρησης που περιείχε ρυθμιστικό διάλυμα έκπλυσης και διαχωρίστηκαν για 25 λεπτά σε τάση 0,6 V/cm. Τέλος, οι αντικειμενοφόρες πλάκες πλύθηκαν με απεσταγμένο νερό, χρωματίστηκαν με 10 μg/mL ιωδιούχο προπίδιο και αναλύθηκαν με μικροσκοπία φθορισμού.
2.7. Ανοσοφθορισμός
Τα κύτταρα σπάρθηκαν σε γυάλινες καλυπτρίδες σε μια πλάκα 12 φρεατίων και επιμολύνθηκαν με το υποδεικνυόμενο πλασμίδιο για 24 ώρες. Στη συνέχεια, τα κύτταρα υποβλήθηκαν σε επεξεργασία με ή χωρίς αντιδραστήρια βλάβης του DNA σύμφωνα με την πειραματική διάταξη. Τα κύτταρα σταθεροποιήθηκαν σε 4% παραφορμαλδεΰδη (PFA) σε PBS για 20 λεπτά σε RT και στη συνέχεια διαπερατήθηκαν σε 0,5% Triton X-100 για 10 λεπτά. Τα πλακίδια μπλοκαρίστηκαν σε 5% φυσιολογικό ορό κατσίκας (NGS) και επωάστηκαν με πρωτογενή αντισώματα αραιωμένα σε 1% NGS όλη τη νύχτα στους 4 °C. Τα δείγματα στη συνέχεια επωάστηκαν με τα υποδεικνυόμενα δευτερεύοντα αντισώματα επισημασμένα με Alexa Fluor 488 ή 555 (Invitrogen) αραιωμένο σε 1% NGS σε RT για 1 ώρα. Στη συνέχεια, χρωματίστηκαν με DAPI για 15 λεπτά σε RT. Τα καλύμματα τοποθετήθηκαν χρησιμοποιώντας μέσο στήριξης Dako Fluorescence Mounting Medium (Agilent) και απεικονίστηκαν χρησιμοποιώντας ένα συνεστιακό μικροσκόπιο Nikon (Eclipse C1 Plus).
2.8. Ανάλυση του ανασυνδυασμού V(D)J
Εν συντομία, το πλασμίδιο αναφοράς V(D)J περιέχει ανεστραμμένο-GFP και IRES που οδηγεί σε συνεχή εκφραζόμενη RFP. Το RFP που εκφράζεται συνεχώς είναι ο έλεγχος εσωτερικής επιμόλυνσης. Αφού το γονίδιο ενεργοποίησης ανασυνδυασμού 1/2 (RAG1/2) συν-μορφομετατραπεί στα κύτταρα, το RAG1/2 θα κόψει το RSS και θα διαμεσολαβήσει την επαγωγή των DSBs, εάν συμβεί ανασυνδυασμός V(D)J, τα ανεστραμμένα GFP συνδέονται με θετική σειρά με NHEJ επισκευή. Τότε το κελί θα εκφράσει λειτουργικό GFP. Έτσι, τα διπλά θετικά κύτταρα GFP και RFP είναι η ανάγνωση της ανάλυσης αναφοράς V(D)J [ 18]. Κύτταρα 293Τ σε συρροή 70% επιμολύνθηκαν με τον V(D)J GFP reporter μόνο (υπόβαθρο) ή σε συνδυασμό με κατασκευές έκφρασης RAG1 και RAG2, σε αναλογία 1 μg V(D)J αναφοράς GFP: 0,5 μg RAG1: 0,5 μg RAG2. Την επόμενη ημέρα, το μέσο άλλαξε και μετά από επιπλέον 48 ώρες, τα κύτταρα συλλέχθηκαν και αναλύθηκαν με κυτταρομετρία ροής για έκφραση GFP και RFP.
2.9. Στατιστική ανάλυση
Όλα τα πειράματα επαναλήφθηκαν τουλάχιστον τρεις φορές χρησιμοποιώντας ανεξάρτητα συλλεχθέντα ή παρασκευασμένα δείγματα. Τα δεδομένα αναλύθηκαν με τη δοκιμή Student's t ή ANOVA ακολουθούμενη από δοκιμές πολλαπλής σύγκρισης του Tukey χρησιμοποιώντας το GraphPad 8.
3. Αποτελέσματα
3.1. Επίδραση των πυρηνικών-τοπικοποιημένων ιικών πρωτεϊνών SARS-CoV-2 στην αποκατάσταση της βλάβης του DNA
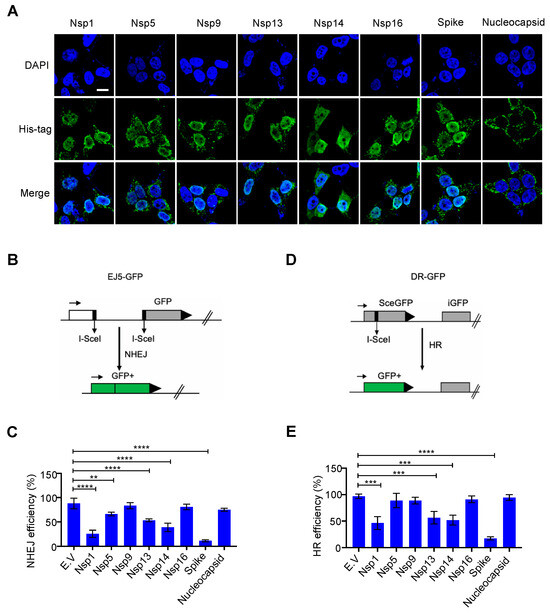
Η αποκατάσταση της βλάβης του DNA συμβαίνει κυρίως στον πυρήνα για να διασφαλιστεί η σταθερότητα του γονιδιώματος. Αν και οι πρωτεΐνες SARS-CoV-2 συντίθενται στο κυτταρόπλασμα [ 1 ], ορισμένες ιικές πρωτεΐνες είναι επίσης ανιχνεύσιμες στον πυρήνα, συμπεριλαμβανομένων των Nsp1, Nsp5, Nsp9, Nsp13, Nsp14 και Nsp16 [ 19 ]. Ερευνήσαμε εάν αυτές οι πυρηνικά εντοπισμένες πρωτεΐνες SARS-CoV-2 επηρεάζουν το σύστημα επιδιόρθωσης βλάβης του DNA του κυττάρου ξενιστή. Για αυτό, κατασκευάσαμε αυτά τα πλασμίδια έκφρασης ιικών πρωτεϊνών μαζί με πλασμίδια έκφρασης ακίδας και νουκλεοπρωτεϊνών, τα οποία γενικά θεωρούνται πρωτεΐνες εντοπισμένες σε κυτταρόπλασμα. Επιβεβαιώσαμε την έκφραση και τον εντοπισμό τους με ανοσοστύπωση και ανοσοφθορισμό ( Εικόνα 1 Α και Εικόνα S1A ). Τα αποτελέσματά μας ήταν συνεπή με αυτά από προηγούμενες μελέτες [19 ]; Οι πρωτεΐνες Nsp1, Nsp5, Nsp9, Nsp13, Nsp14 και Nsp16 είναι πράγματι εντοπισμένες στον πυρήνα και οι νουκλεοπρωτεΐνες εντοπίζονται κυρίως στο κυτταρόπλασμα. Παραδόξως, βρήκαμε την αφθονία της πρωτεΐνης ακίδας στον πυρήνα ( Εικόνα 1 Α). Η επισκευή NHEJ και ο ομόλογος ανασυνδυασμός (HR) είναι δύο κύριες οδοί επιδιόρθωσης του DNA που όχι μόνο παρακολουθούν συνεχώς και διασφαλίζουν την ακεραιότητα του γονιδιώματος αλλά είναι επίσης ζωτικής σημασίας για τις προσαρμοστικές λειτουργίες του ανοσοποιητικού κυττάρου [ 9 ]. Για να αξιολογήσουμε εάν αυτές οι ιικές πρωτεΐνες εμποδίζουν την οδό επιδιόρθωσης του DSB, εξετάσαμε την επιδιόρθωση ενός DSB ειδικού θέσης που προκαλείται από την ενδονουκλεάση I-SceI χρησιμοποιώντας την πρωτεΐνη άμεσης επανάληψης-πράσινου φθορισμού (DR-GFP) και την ολική-NHEJ-GFP ( EJ5–GFP) συστήματα αναφοράς για HR και NHEJ, αντίστοιχα [ 15 , 16]. Η υπερέκφραση των πρωτεϊνών Nsp1, Nsp5, Nsp13, Nsp14 και ακίδας μείωσε την αποτελεσματικότητα τόσο της επισκευής HR όσο και της NHEJ ( Εικόνα 1 B–E και Εικόνα S2A,B ). Επιπλέον, βρήκαμε επίσης ότι η υπερέκφραση των Nsp1, Nsp5, Nsp13 και Nsp14 κατέστειλε δραματικά τον πολλαπλασιασμό σε σύγκριση με άλλες πρωτεΐνες που μελετήθηκαν ( Εικόνα S3A,B ). Ως εκ τούτου, η ανασταλτική επίδραση των Nsp1, Nsp5, Nsp13 και Nsp14 στην αποκατάσταση της βλάβης του DNA μπορεί να οφείλεται σε δευτερογενείς επιδράσεις, όπως η διακοπή της ανάπτυξης και ο κυτταρικός θάνατος. Είναι ενδιαφέρον ότι η υπερεκφρασμένη πρωτεΐνη ακίδας δεν επηρέασε τη μορφολογία ή τον πολλαπλασιασμό των κυττάρων, αλλά κατέστειλε σημαντικά την επιδιόρθωση τόσο του HR όσο και του NHEJ ( Εικόνα 1 B–E, Εικόνες S2A,B και S3A,B ).
Ιοί 13 02056 g001 550Εικόνα 1. Επίδραση πυρηνικών εντοπισμένων πρωτεϊνών κοροναϊού 2 (SARS–CoV–2) με σοβαρό οξύ αναπνευστικό σύνδρομο στην επιδιόρθωση βλάβης του DNA. ( Α ) Υποκυτταρική κατανομή των πρωτεϊνών SARS–CoV–2. Ο ανοσοφθορισμός πραγματοποιήθηκε στις 24 ώρες μετά τη διαμόλυνση του πλασμιδίου που εκφράζει τις ιικές πρωτεΐνες σε κύτταρα ΗΕΚ293Τ. Μπάρα κλίμακας: 10 μm. ( B ) Σχηματική απεικόνιση του ανταποκριτή EJ5-GFP που χρησιμοποιείται για την παρακολούθηση της μη ομόλογης σύνδεσης άκρου (NHEJ). ( Γ ) Επίδραση του κενού φορέα (EV) και των πρωτεϊνών SARS-CoV-2 στην επιδιόρθωση του NHEJ DNA. Οι τιμές αντιπροσωπεύουν τη μέση ± τυπική απόκλιση (SD) από τρία ανεξάρτητα πειράματα (βλέπε αντιπροσωπευτικές γραφικές παραστάσεις FACS στο Σχήμα S2A ). ( Δ) Σχηματική απεικόνιση του ανταποκριτή DR-GFP που χρησιμοποιείται για την παρακολούθηση του ομόλογου ανασυνδυασμού (HR). ( Ε ) Επίδραση των πρωτεϊνών EV και SARS-CoV-2 στην επιδιόρθωση του HR DNA. Οι τιμές αντιπροσωπεύουν τη μέση ± SD από τρία ανεξάρτητα πειράματα (βλέπε αντιπροσωπευτικές γραφικές παραστάσεις FACS στο Σχήμα S2B ). Οι τιμές αντιπροσωπεύουν τη μέση τιμή ± SD, η = 3. Η στατιστική σημασία προσδιορίστηκε χρησιμοποιώντας μονόδρομη ανάλυση διακύμανσης (ANOVA) στο ( C , E ). ** p < 0,01, *** p < 0,001, **** p < 0,0001.
3.2. Η πρωτεΐνη SARS–CoV–2 Spike αναστέλλει την αποκατάσταση της βλάβης του DNA
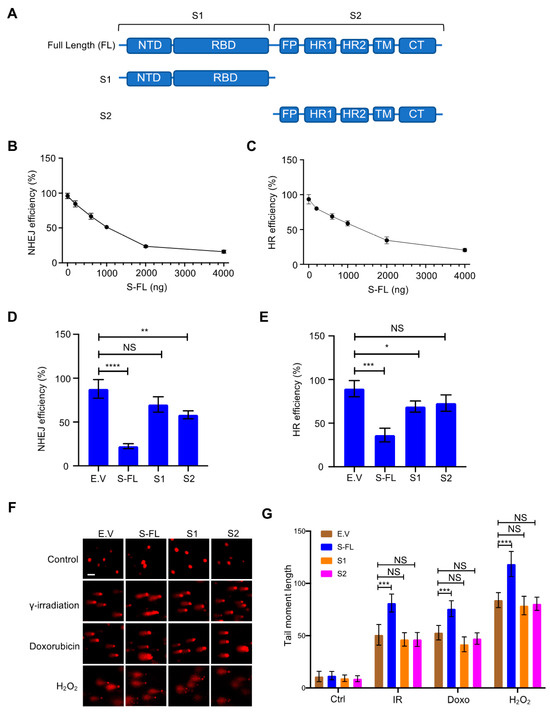
Επειδή οι πρωτεΐνες ακίδας είναι κρίσιμες για τη μεσολάβηση της εισόδου του ιού στα κύτταρα ξενιστές και αποτελούν το επίκεντρο των περισσότερων στρατηγικών εμβολίων [ 20 , 21 ], διερευνήσαμε περαιτέρω τον ρόλο των πρωτεϊνών αιχμής στην επιδιόρθωση βλάβης του DNA και τον σχετικό ανασυνδυασμό V(D)J. Οι πρωτεΐνες αιχμής συνήθως πιστεύεται ότι συντίθενται στο τραχύ ενδοπλασματικό δίκτυο (ER) [ 1 ]. Μετά από μεταμεταφραστικές τροποποιήσεις όπως η γλυκοζυλίωση, οι πρωτεΐνες ακίδας διακινούνται μέσω της συσκευής της κυτταρικής μεμβράνης μαζί με άλλες ιικές πρωτεΐνες για να σχηματίσουν το ώριμο ιοσωμάτιο [ 1 ]. Η πρωτεΐνη Spike περιέχει δύο κύριες υπομονάδες, S1 και S2, καθώς και αρκετούς λειτουργικούς τομείς ή επαναλήψεις [ 22 ] ( Εικόνα 2ΕΝΑ). Στη φυσική κατάσταση, οι πρωτεΐνες ακίδας υπάρχουν ως ανενεργές πρωτεΐνες πλήρους μήκους. Κατά τη διάρκεια της ιογενούς μόλυνσης, οι πρωτεάσες του κυττάρου ξενιστή, όπως η πρωτεάση της φουρίνης, ενεργοποιούν την πρωτεΐνη S διασπώντας την σε υπομονάδες S1 και S2, οι οποίες είναι απαραίτητες για την είσοδο του ιού στο κύτταρο στόχο [ 23 ]. Εξερευνήσαμε περαιτέρω διαφορετικές υπομονάδες της πρωτεΐνης ακίδας για να διασαφηνίσουμε τα λειτουργικά χαρακτηριστικά που απαιτούνται για την αναστολή επιδιόρθωσης του DNA. Μόνο η πρωτεΐνη ακίδας πλήρους μήκους ανέστειλε έντονα την επιδιόρθωση τόσο του NHEJ όσο και του HR ( Εικόνα 2 B–E και Εικόνα S4A,B). Στη συνέχεια, προσπαθήσαμε να προσδιορίσουμε εάν η πρωτεΐνη ακίδας συμβάλλει άμεσα στη γονιδιωματική αστάθεια αναστέλλοντας την επιδιόρθωση του DSB. Παρακολουθήσαμε τα επίπεδα των DSB χρησιμοποιώντας αναλύσεις κομητών. Μετά από διαφορετικές θεραπείες βλάβης του DNA, όπως η ακτινοβολία γ, η θεραπεία με δοξορουβικίνη και η θεραπεία με H 2 O 2 , υπάρχει λιγότερη επιδιόρθωση παρουσία της πρωτεΐνης ακίδας ( Εικόνα 2 F, G). Μαζί, αυτά τα δεδομένα δείχνουν ότι η πρωτεΐνη ακίδας επηρεάζει άμεσα την επιδιόρθωση του DNA στον πυρήνα.
Ιοί 13 02056 g002 550Εικόνα 2. Η πρωτεΐνη ακίδας του κορωνοϊού 2 (SARS–CoV–2) με σοβαρό οξύ αναπνευστικό σύνδρομο αναστέλλει την αποκατάσταση της βλάβης του DNA. ( Α ) Σχηματική της πρωτογενούς δομής της πρωτεΐνης ακίδας SARS–CoV–2. Η υπομονάδα S1 περιλαμβάνει μια Ν-τελική περιοχή (NTD, 14-305 υπολείμματα) και μια περιοχή δέσμευσης υποδοχέα (RBD, 319-541 υπολείμματα). Η υπομονάδα S2 αποτελείται από το πεπτίδιο σύντηξης (FP, 788-806 υπολείμματα), την αλληλουχία επανάληψης επταπεπτιδίου 1 (HR1, 912-984 υπολείμματα), HR2 (1163-1213 υπολείμματα), περιοχή ΤΜ (TM, 1213-1237 υπολείμματα) και τομέας κυτταροπλάσματος (CT, 1237-1273 κατάλοιπα). ( Β , Γ ) Επίδραση της τιτλοδοτημένης έκφρασης της πρωτεΐνης ακίδας στην επιδιόρθωση του DNA σε κύτταρα HEK-293T. ( Δ , Ε) Μόνο η πρωτεΐνη ακίδας πλήρους μήκους αναστέλλει την επιδιόρθωση του DNA της μη ομόλογης σύνδεσης άκρου (NHEJ) και του ομόλογου ανασυνδυασμού (HR). Οι τιμές αντιπροσωπεύουν τη μέση τιμή ± SD από τρία ανεξάρτητα πειράματα (βλέπε αντιπροσωπευτικές γραφικές παραστάσεις FACS στο Σχήμα S4A,B ). ( ΣΤ ) Κύτταρα HEK293T που έχουν διαμολυνθεί με πρωτεΐνες πλήρους μήκους ακίδας (S-FL) εμφάνισαν μεγαλύτερη βλάβη στο DNA από κενά κύτταρα που είχαν διαμολυνθεί με φορέα, S1- και S2 υπό διαφορετικές συνθήκες βλάβης του DNA. Για δοξορουβικίνη: 4 μg/mL, 2 ώρες. Για γ–ακτινοβολία: 10 Gy, 30 min. Για H 2 O 2 : 100 μΜ, 1 h. Μπάρα κλίμακας: 50 μm. ( Ζ ) Αντίστοιχη ποσοτικοποίηση των ροπών της ουράς του κομήτη από 20 διαφορετικά πεδία με n> 200 κομήτες τριών ανεξάρτητων πειραμάτων. Η στατιστική σημασία αξιολογήθηκε χρησιμοποιώντας μια αμφίδρομη ανάλυση διακύμανσης (ANOVA). NS (Μη σημαντικό): * p > 0,05, ** p < 0,01, *** p < 0,001, **** p < 0,0001.
3.3. Οι πρωτεΐνες Spike εμποδίζουν τη στρατολόγηση πρωτεϊνών σημείων ελέγχου επιδιόρθωσης ζημιών DNA
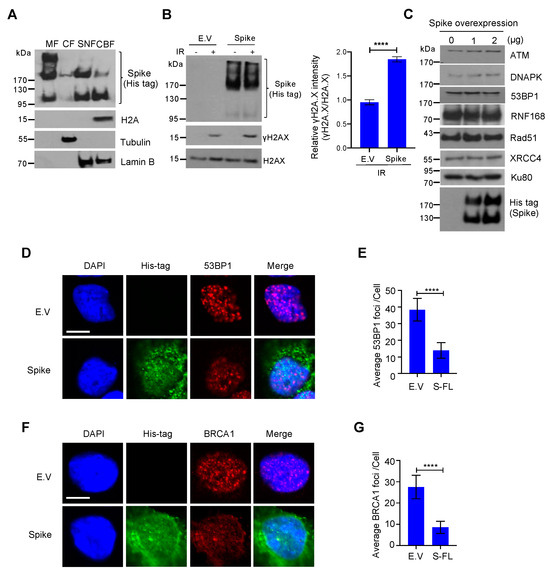
Για να επιβεβαιώσουμε την ύπαρξη πρωτεΐνης ακίδας στον πυρήνα, πραγματοποιήσαμε ανάλυση υποκυτταρικού κλάσματος και διαπιστώσαμε ότι οι πρωτεΐνες ακίδας δεν είναι μόνο εμπλουτισμένες στο κλάσμα της κυτταρικής μεμβράνης αλλά είναι επίσης άφθονες στο πυρηνικό κλάσμα, με ανιχνεύσιμη έκφραση ακόμη και στο κλάσμα που συνδέεται με τη χρωματίνη ( Εικόνα 3 Α). Παρατηρήσαμε επίσης ότι η ακίδα έχει τρεις διαφορετικές μορφές, η υψηλότερη ζώνη είναι μια άκρως γλυκοζυλιωμένη ακίδα, η μεσαία είναι μια ακίδα πλήρους μήκους και η κάτω είναι μια υπομονάδα ακίδας με σχισμή. Σε συμφωνία με τον προσδιορισμό κομήτη, βρήκαμε επίσης την ανοδική ρύθμιση του δείκτη βλάβης του DNA, γ-H2A.X, σε κύτταρα υπερεκφρασμένα από πρωτεΐνες ακίδας υπό συνθήκες βλάβης του DNA ( Εικόνα 3 Β). Μια πρόσφατη μελέτη πρότεινε ότι οι πρωτεΐνες αιχμής προκαλούν στρες ER και αποικοδόμηση πρωτεϊνών που σχετίζεται με το ER [24 ]. Για να αποκλείσουμε την πιθανότητα ότι η πρωτεΐνη ακίδας αναστέλλει την επιδιόρθωση του DNA προάγοντας την αποικοδόμηση της πρωτεΐνης επιδιόρθωσης του DNA, ελέγξαμε την έκφραση ορισμένων βασικών πρωτεϊνών επιδιόρθωσης DNA στα μονοπάτια επιδιόρθωσης NHEJ και HR και βρήκαμε ότι αυτές οι πρωτεΐνες επιδιόρθωσης DNA ήταν σταθερές μετά από υπερέκφραση πρωτεΐνης ακίδας ( Εικόνα 3 ΝΤΟ). Για να προσδιορίσουμε πώς η πρωτεΐνη ακίδας αναστέλλει τις οδούς επιδιόρθωσης NHEJ και HR, αναλύσαμε τη στρατολόγηση των BRCA1 και 53BP1, οι οποίες είναι οι βασικές πρωτεΐνες του σημείου ελέγχου για την επισκευή HR και NHEJ, αντίστοιχα. Βρήκαμε ότι η πρωτεΐνη ακίδας ανέστειλε σημαντικά τον σχηματισμό εστιών BRCA1 και 53BP1 ( Εικόνα 3 D-G). Μαζί, αυτά τα δεδομένα δείχνουν ότι η πρωτεΐνη ακίδας πλήρους μήκους SARS-CoV-2 αναστέλλει την επιδιόρθωση βλάβης στο DNA παρεμποδίζοντας τη στρατολόγηση πρωτεϊνών επισκευής DNA.
Ιοί 13 02056 g003 550Εικόνα 3. Η πρωτεΐνη ακίδας του κορωνοϊού 2 (SARS–CoV–2) με σοβαρό οξύ αναπνευστικό σύνδρομο εμποδίζει τη στρατολόγηση πρωτεϊνών σημείου ελέγχου επιδιόρθωσης βλάβης του DNA. ( Α ) Το κλάσμα μεμβράνης (MF), το κυτοσολικό κλάσμα (CF), το διαλυτό πυρηνικό κλάσμα (SNF) και το κλάσμα δεσμευμένο στη χρωματίνη (CBF) από κύτταρα HEK293T που επιμολύνθηκαν με πρωτεΐνη ακίδας SARS-CoV-2 ανοσοστυπώθηκαν για ακίδα His-tag και ενδεικνυόμενες πρωτεΐνες. ( B ) Αριστερά: Ανοσοκηλίδες του δείκτη βλάβης DNA γH2AX σε κενό φορέα (EV) – και πρωτεΐνη ακίδας – που εκφράζουν κύτταρα HEK293T μετά από ακτινοβολία γ 10 Gy. Δεξιά: αντίστοιχος ποσοτικός προσδιορισμός των ανοσοκηλίδων στα αριστερά. Οι τιμές αντιπροσωπεύουν τη μέση τιμή ± SD ( n = 3). Η στατιστική σημασία προσδιορίστηκε χρησιμοποιώντας το Student's t- test. **** σελ < 0,0001. ( Γ ) Ανοσοκηλιδώματα βλάβης του DNA επιδιορθώνουν τις σχετικές πρωτεΐνες σε κύτταρα HEK293T που εκφράζουν πρωτεΐνη ακίδας. ( D ) Αντιπροσωπευτικές εικόνες σχηματισμού εστιών 53BP1 σε κύτταρα HEK293 που εκφράζουν πρωτεΐνες EV- και ακίδα που εκτίθενται σε ακτινοβολία γ 10 Gy. Μπάρα κλίμακας: 10 μm. ( Ε ) Ποσοτική ανάλυση εστιών 53BP1 ανά πυρήνα. Οι τιμές αντιπροσωπεύουν τη μέση τιμή ± SEM, n = 50. ( F ) Σχηματισμός εστιών BRCA1 σε κενά κύτταρα HEK293 που εκφράζουν πρωτεΐνες ακίδας και φορέα που εκτίθενται σε ακτινοβολία γ 10 Gy. Μπάρα κλίμακας: 10 μm. ( G ). Ποσοτική ανάλυση εστιών BRCA1 ανά πυρήνα. Οι τιμές αντιπροσωπεύουν τη μέση τιμή ± SEM, n = 50. Η στατιστική σημασία προσδιορίστηκε χρησιμοποιώντας Student's t-δοκιμή. **** p < 0,0001.
3.4. Η πρωτεΐνη Spike επηρεάζει τον ανασυνδυασμό V(D)J In vitro
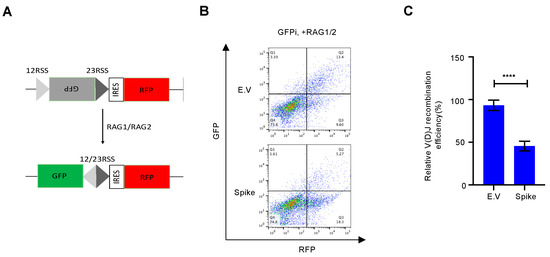
Η αποκατάσταση της βλάβης του DNA, ειδικά η επιδιόρθωση του NHEJ, είναι απαραίτητη για τον ανασυνδυασμό V(D)J, ο οποίος βρίσκεται στον πυρήνα της ανοσίας των Β και Τ κυττάρων [ 9 ]. Μέχρι σήμερα, πολλά εγκεκριμένα εμβόλια SARS–CoV–2, όπως τα εμβόλια mRNA και τα εμβόλια αδενοϊού–COVID–19, έχουν αναπτυχθεί με βάση την πρωτεΐνη ακίδας πλήρους μήκους [ 25 ]. Αν και είναι αμφισβητήσιμο εάν το SARS-CoV-2 μολύνει άμεσα πρόδρομες ενώσεις λεμφοκυττάρων [ 26 , 27 ], ορισμένες αναφορές έχουν δείξει ότι τα μολυσμένα κύτταρα εκκρίνουν εξωσώματα που μπορούν να μεταφέρουν RNA ή πρωτεΐνη SARS-CoV-2 στα κύτταρα στόχους [ 28 , 29]. Δοκιμάσαμε περαιτέρω εάν η πρωτεΐνη ακίδας μείωσε τον ανασυνδυασμό V(D)J που προκαλείται από NHEJ. Για αυτό, σχεδιάσαμε ένα in vitro σύστημα αναφοράς ανασυνδυασμού V(D)J σύμφωνα με μια προηγούμενη μελέτη [ 18 ] ( Εικόνα S5 ). Σε σύγκριση με τον κενό φορέα, η υπερέκφραση της πρωτεΐνης ακίδας ανέστειλε τον ανασυνδυασμό V(D)J με τη μεσολάβηση RAG σε αυτό το in vitro σύστημα αναφοράς ( Εικόνα 4 ).
Ιοί 13 02056 g004 550Σχήμα 4. Η πρωτεΐνη Spike επηρεάζει τον ανασυνδυασμό V(D)J in vitro. ( A ) Σχηματική απεικόνιση του συστήματος αναφοράς V(D)J. ( Β ) Αντιπροσωπευτικά γραφήματα κυτταρομετρίας ροής δείχνουν ότι η πρωτεΐνη ακίδας SARS–CoV–2 εμποδίζει τον ανασυνδυασμό V(D)J in vitro. ( Γ ) Ποσοτική ανάλυση του σχετικού ανασυνδυασμού V(D)J. Οι τιμές αντιπροσωπεύουν τη μέση τιμή ± SD, η = 3. Η στατιστική σημασία προσδιορίστηκε χρησιμοποιώντας το Student's t- test. **** p < 0,0001.
4. Συζήτηση
Τα ευρήματά μας παρέχουν ενδείξεις ότι η πρωτεΐνη ακίδας πειράζει τον μηχανισμό επιδιόρθωσης βλάβης του DNA και τον προσαρμοστικό ανοσοποιητικό μηχανισμό in vitro. Προτείνουμε έναν πιθανό μηχανισμό με τον οποίο οι πρωτεΐνες ακίδας μπορεί να βλάψουν την προσαρμοστική ανοσία αναστέλλοντας την επιδιόρθωση βλάβης του DNA. Αν και δεν έχουν δημοσιευθεί στοιχεία ότι ο SARS-CoV-2 μπορεί να μολύνει θυμοκύτταρα ή λεμφοειδή κύτταρα μυελού των οστών, η in vitro δοκιμασία αναφοράς V(D)J δείχνει ότι η πρωτεΐνη ακίδας εμπόδισε έντονα τον ανασυνδυασμό V(D)J. Σύμφωνα με τα αποτελέσματά μας, οι κλινικές παρατηρήσεις δείχνουν επίσης ότι ο κίνδυνος σοβαρής ασθένειας ή θανάτου με COVID-19 αυξάνεται με την ηλικία, ειδικά οι ηλικιωμένοι ενήλικες που διατρέχουν τον υψηλότερο κίνδυνο [ 22]. Αυτό μπορεί να οφείλεται στο ότι οι πρωτεΐνες ακίδας SARS–CoV–2 μπορούν να αποδυναμώσουν το σύστημα επιδιόρθωσης DNA των ηλικιωμένων και κατά συνέπεια να εμποδίσουν τον ανασυνδυασμό V(D)J και την προσαρμοστική ανοσία. Αντίθετα, τα δεδομένα μας παρέχουν πολύτιμες λεπτομέρειες σχετικά με τη συμμετοχή των υπομονάδων πρωτεΐνης ακίδας στην επιδιόρθωση βλάβης του DNA, υποδεικνύοντας ότι τα εμβόλια πλήρους μήκους που βασίζονται σε ακίδα μπορεί να αναστείλουν τον ανασυνδυασμό του V(D)J στα Β κύτταρα, κάτι που είναι επίσης σύμφωνο με ένα πρόσφατο μελέτη ότι ένα εμβόλιο πλήρους μήκους που βασίζεται σε ακίδα προκάλεσε χαμηλότερους τίτλους αντισωμάτων σε σύγκριση με το εμβόλιο με βάση το RBD [ 28]. Αυτό υποδηλώνει ότι η χρήση αντιγονικών επιτόπων της ακίδας ως εμβόλιο SARS–CoV–2 μπορεί να είναι ασφαλέστερη και πιο αποτελεσματική από την ακίδα πλήρους μήκους. Συνολικά, εντοπίσαμε έναν από τους δυνητικά σημαντικούς μηχανισμούς καταστολής του SARS-CoV-2 του προσαρμοστικού ανοσοποιητικού μηχανισμού του ξενιστή. Επιπλέον, τα ευρήματά μας υποδηλώνουν επίσης μια πιθανή παρενέργεια του εμβολίου πλήρους μήκους με βάση την ακίδα. Αυτή η εργασία θα βελτιώσει την κατανόηση της παθογένεσης του COVID-19 και θα παράσχει νέες στρατηγικές για το σχεδιασμό πιο αποτελεσματικών και ασφαλέστερων εμβολίων.
Συμπληρωματικά Υλικά
Τα ακόλουθα είναι διαθέσιμα στο διαδίκτυο στη διεύθυνση https://www.mdpi.com/article/10.3390/v13102056/s1 , Εικόνα S1: Έκφραση πυρηνικών εντοπισμένων πρωτεϊνών SARS–CoV–2 σε ανθρώπινα κύτταρα, Εικόνα S2: Επίδραση πυρηνικού SARS– Οι πρωτεΐνες CoV-2 στο μονοπάτι επιδιόρθωσης NHEJ– και HR–DNA, Εικόνα S3: Τα Nsp1, Nsp5, Nsp13, Nsp14 αλλά όχι η ακίδα αναστέλλουν τον κυτταρικό πολλαπλασιασμό, Εικόνα S4: Επίδραση μεταλλαγμάτων ακίδας SARS–CoV–2 στο NHEJ– και HR– DNA μονοπάτι επισκευής, Εικόνα S5: In vitro προσδιορισμός ανασυνδυασμού V(D)J.
Συνεισφορές Συγγραφέων
Ο HJ συνέλαβε και σχεδίασε τη μελέτη. Οι HJ και Y.-FM επέβλεψαν τη μελέτη, πραγματοποίησαν πειράματα και ερμήνευσαν τα δεδομένα. Γράψιμο—προετοιμασία πρωτότυπου σχεδίου, HJ; Γράψιμο — κριτική και επεξεργασία, HJ και Y.-FM. εξαγορά χρηματοδότησης, Y.-FM Όλοι οι συγγραφείς έχουν διαβάσει και έχουν συμφωνήσει με τη δημοσιευμένη έκδοση τ
1. Εισαγωγή
Το σοβαρό οξύ αναπνευστικό σύνδρομο κοροναϊός 2 (SARS–CoV–2) είναι υπεύθυνος για τη συνεχιζόμενη πανδημία της νόσου του κορωνοϊού 2019 (COVID–19) που έχει οδηγήσει σε περισσότερους από 2,3 εκατομμύρια θανάτους. Ο SARS-CoV-2 είναι ένας περικαλυμμένος ιός RNA θετικής αίσθησης που αποτελείται από δομικές και μη δομικές πρωτεΐνες [ 1 ]. Μετά τη μόλυνση, αυτές οι ιικές πρωτεΐνες καταλαμβάνουν και απορυθμίζουν τον κυτταρικό μηχανισμό του ξενιστή για να αναπαραχθούν, να συναρμολογηθούν και να διαδοθούν οι απογονικοί ιοί [ 2 ]. Πρόσφατες κλινικές μελέτες έχουν δείξει ότι η λοίμωξη από SARS-CoV-2 επηρεάζει εξαιρετικά τον αριθμό και τη λειτουργία των λεμφοκυττάρων [ 3 , 4 , 5 , 6]. Σε σύγκριση με τους ήπιους και μέτριους επιζώντες, οι ασθενείς με σοβαρό COVID-19 εμφανίζουν σημαντικά χαμηλότερο αριθμό ολικών Τ κυττάρων, βοηθητικών Τ κυττάρων και κατασταλτικών Τ κυττάρων [ 3 , 4 ]. Επιπλέον, ο COVID-19 καθυστερεί τα επίπεδα IgG και IgM μετά την έναρξη των συμπτωμάτων [ 5 , 6 ]. Συλλογικά, αυτές οι κλινικές παρατηρήσεις υποδηλώνουν ότι ο SARS-CoV-2 επηρεάζει το προσαρμοστικό ανοσοποιητικό σύστημα. Ωστόσο, ο μηχανισμός με τον οποίο ο SARS-CoV-2 καταστέλλει την προσαρμοστική ανοσία παραμένει ασαφής.
Ως δύο κρίσιμα συστήματα επιτήρησης του ξενιστή, το ανοσοποιητικό σύστημα και το σύστημα επιδιόρθωσης DNA είναι τα κύρια συστήματα στα οποία βασίζονται οι ανώτεροι οργανισμοί για την άμυνα έναντι διαφόρων απειλών και την ομοιόσταση των ιστών. Αναδυόμενα στοιχεία δείχνουν ότι αυτά τα δύο συστήματα αλληλοεξαρτώνται, ειδικά κατά την ανάπτυξη και την ωρίμανση των λεμφοκυττάρων [ 7 ]. Ως μία από τις κύριες οδούς επιδιόρθωσης θραύσης διπλού κλώνου DNA (DSB), η επιδιόρθωση μη ομόλογης σύνδεσης άκρου (NHEJ) διαδραματίζει κρίσιμο ρόλο στον ανασυνδυασμό V(D)J που προκαλείται από τον ειδικό ανασυνδυασμό των λεμφοκυττάρων (RAG). το οποίο έχει ως αποτέλεσμα ένα εξαιρετικά ποικιλόμορφο ρεπερτόριο αντισωμάτων σε Β-λεμφοκύτταρα και υποδοχείς Τ-λεμφοκυττάρων (TCRs) στα Τ κύτταρα [ 8]. Για παράδειγμα, η απώλεια λειτουργίας βασικών πρωτεϊνών επιδιόρθωσης του DNA όπως ATM, DNA-PKcs, 53BP1, et al., οδηγεί σε ελαττώματα στην επιδιόρθωση του NHEJ που αναστέλλουν την παραγωγή λειτουργικών Β και Τ κυττάρων, οδηγώντας σε ανοσοανεπάρκεια [ 7 , 9 , 10 , 11 ]. Αντίθετα, η ιογενής λοίμωξη προκαλεί συνήθως βλάβη στο DNA μέσω διαφορετικών μηχανισμών, όπως η πρόκληση παραγωγής αντιδραστικών ειδών οξυγόνου (ROS) και το στρες αντιγραφής του κυττάρου ξενιστή [ 12 , 13 , 14]. Εάν η βλάβη του DNA δεν μπορεί να επιδιορθωθεί σωστά, θα συμβάλει στην ενίσχυση της παθολογίας που προκαλείται από ιογενείς λοιμώξεις. Ως εκ τούτου, στοχεύσαμε να διερευνήσουμε εάν οι πρωτεΐνες SARS-CoV-2 παραβιάζουν το σύστημα αποκατάστασης βλάβης του DNA, επηρεάζοντας έτσι την προσαρμοστική ανοσία in vitro.
2. Υλικά και μέθοδοι
2.1. Αντισώματα και Αντιδραστήρια
ΫΑΡΙ (Cat # MBD0015), δοξορουβικίνη (Cat # D1515), H 2 O 2 (Cat # Η1009), και τα αντισώματα β-τουμπουλίνης (Cat # T4026) αγοράστηκαν από την Sigma-Aldrich. Αντισώματα κατά της ετικέτας His (Cat #12698), H2A (Cat #12349), H2A.X (Cat #7631), γ–H2A.X (Cat #2577), Ku80 (Cat # 2753) και Rad51 (Cat #8875 ) αγοράστηκαν από την Cell Signaling Technology (Danvers, MA, ΗΠΑ). Τα αντισώματα 53BP1 (Cat #NB100-304) και RNF168 (Cat #H00165918–M01) ελήφθησαν από τη Novus Biologicals (Novus Biologicals, Littleton, CO, USA). Αντισώματα Lamin B (Cat #sc–374015), ATM (Cat #sc–135663), DNA–PK (Cat #sc–5282) και BRCA1 (Cat #sc–28383) αγοράστηκαν από την Santa Cruz Biotechnology (Santa Cruz, CA, ΗΠΑ). Το αντίσωμα XRCC4 (Cat #PA5-82264) αγοράστηκε από την Thermo Fisher Scientific (Waltham, ΜΑ, ΗΠΑ).
2.2. Πλασμίδια
Τα pHPRT–DRGFP και pCBASceI δόθηκαν ευγενικά από τη Maria Jasin (Addgene πλασμίδια #26476 και #26477) [ 15 ]. Το pimEJ5GFP ήταν ένα δώρο από τον Jeremy Stark (Addgene πλασμίδιο #44026) [ 16]. Οι πρωτεΐνες NSP1, NSP9, NSP13, NSP14, NSP16, spike και νουκλεοκαψιδικών πρωτεϊνών αρχικά συντέθηκαν με βελτιστοποίηση κωδικονίων και στη συνέχεια κλωνοποιήθηκαν σε φορέα έκφρασης θηλαστικού pUC57 με C-τελική ετικέτα 6xHis. Μια ανεστραμμένη συμπληρωματική αλληλουχία RSS-GFP 12-διαχωριστών-ένα RSS 23-διαστήματος συντέθηκε για το διάνυσμα αναφοράς V(D)J. Στη συνέχεια, η αλληλουχία κλωνοποιήθηκε στον φορέα pBabe–IRES–mRFP για να δημιουργηθεί ο φορέας αναφοράς pBabe–12RSS–GFPi–23RSS–IRES–mRFP. 12–ακολουθία RSS διαστήματος: 5′–CACAGTGCTACAGACTGGAACAAAAACC–3′. 23–αλληλουχία RSS διαστήματος: 5′–CACAGTGGTAGTACTCACTGTCTGGCTGTACAAAAACC–3′. Τα κατασκευάσματα έκφρασης RAG1 και RAG2 δόθηκαν γενναιόδωρα από τον Martin Gellert (πλασμίδιο Addgene #13328 και #13329) [ 17 ].
2.3. Κύτταρα και Κυτταρική Καλλιέργεια
ΗΕΚ293Τ και ΗΕΚ293 κύτταρα που ελήφθησαν από την American Type Culture Collection (ATCC) καλλιεργήθηκαν κάτω από 5% CO 2 στους 37 ° C σε τροποποιημένο μέσο Eagle του Dulbecco (ϋΜΕΜ, υψηλής γλυκόζης, GlutaMAX) (Life Technologies, Carlsbad, CA, USA) που περιέχει 10 % ( v / v ) ορός εμβρύου μόσχου (FCS, Gibco), 1% ( v / v ) πενικιλίνη (100 IU/mL) και στρεπτομυκίνη (100 μg/mL). Τα κύτταρα αναφοράς HEK293T–DR–GFP και HEK293T–EJ5–GFP δημιουργήθηκαν όπως περιγράφηκε προηγουμένως και καλλιεργήθηκαν υπό 5% CO 2 στους 37 °C στο προαναφερθέν μέσο καλλιέργειας.
2.4. HR και NHEJ Reporter Assays
Η επισκευή HR και NHEJ σε κύτταρα HEK293T μετρήθηκαν όπως περιγράφηκε προηγουμένως χρησιμοποιώντας σταθερά κύτταρα DR-GFP και EJ5-GFP. Εν συντομία, 0,5 × 10 6 σταθερά κύτταρα αναφοράς HEK293T σπάρθηκαν σε πλάκες 6 φρεατίων και επιμολύνθηκαν με πλασμίδιο έκφρασης 2 μg I-SceI (pCBASceI) μαζί με πλασμίδια έκφρασης πρωτεϊνών SARS-CoV-2. Σαράντα οκτώ ώρες μετά τη διαμόλυνση και τη θεραπεία με ασπιρίνη, τα κύτταρα συλλέχθηκαν και αναλύθηκαν με ανάλυση κυτταρομετρίας ροής για έκφραση GFP. Τα μέσα λήφθηκαν από τρία ανεξάρτητα πειράματα.
2.5. Κυτταρική κλασμάτωση και ανοσοστύπωση
Για τον προσδιορισμό κυτταρικού κλάσματος, χρησιμοποιήθηκε το κιτ υποκυτταρικής κλασματοποίησης πρωτεΐνης (Thermo Fisher) σύμφωνα με τις οδηγίες του κατασκευαστή. Τα προϊόντα λύσης πρωτεΐνης ποσοτικοποιήθηκαν χρησιμοποιώντας το αντιδραστήριο BCA (Thermo Fisher Scientific, Rockford, IL, USA). Οι πρωτεΐνες αναλύθηκαν με ηλεκτροφόρηση γέλης δωδεκυλοθειικού νατρίου-πολυακρυλαμιδίου (SDS-PAGE), μεταφέρθηκαν σε μεμβράνες νιτροκυτταρίνης (Amersham protran, 0,45 μm NC) και ανοσοστυπώθηκαν με συγκεκριμένα πρωτογενή αντισώματα ακολουθούμενα από συζευγμένα με HRP δευτερογενή αντισώματα. Οι ζώνες πρωτεΐνης ανιχνεύθηκαν χρησιμοποιώντας κιτ SuperSignal West Pico ή Femto Chemiluminescence (Thermo Fisher Scientific).
2.6. Comet Assay
Τα κύτταρα υποβλήθηκαν σε επεξεργασία με διαφορετικά αντιδραστήρια βλάβης του DNA και στη συνέχεια συλλέχθηκαν στα υποδεικνυόμενα χρονικά σημεία για ανάλυση. Κύτταρα (1 × 10 5κύτταρα/mL σε ψυχρό αλατούχο διάλυμα ρυθμισμένο με φωσφορικά [PBS]) επαναιωρήθηκαν σε αγαρόζη 1% χαμηλής τήξης στους 40 °C σε αναλογία 1:3 vol/vol και μεταφέρθηκαν με πιπέτα σε CometSlide. Οι αντικειμενοφόρες πλάκες μετά βυθίστηκαν σε προψυγμένο ρυθμιστικό λύσης (1,2 Μ NaCl, 100 mM EDTA, 0,1% λαυρυλοσαρκοσινικό νάτριο, 0,26 Μ NaOH pH > 13) για ολονύκτια (18-20 ώρες) λύση στους 4 °C στο σκοτάδι. Οι αντικειμενοφόρες πλάκες στη συνέχεια αφαιρέθηκαν προσεκτικά και βυθίστηκαν σε ρυθμιστικό διάλυμα έκπλυσης (0,03 Μ NaOH και 2 mM EDTA, ρΗ > 12) σε θερμοκρασία δωματίου (RT) για 20 λεπτά στο σκοτάδι. Αυτό το βήμα πλύσης επαναλήφθηκε δύο φορές. Οι αντικειμενοφόρες πλάκες μεταφέρθηκαν σε οριζόντιο θάλαμο ηλεκτροφόρησης που περιείχε ρυθμιστικό διάλυμα έκπλυσης και διαχωρίστηκαν για 25 λεπτά σε τάση 0,6 V/cm. Τέλος, οι αντικειμενοφόρες πλάκες πλύθηκαν με απεσταγμένο νερό, χρωματίστηκαν με 10 μg/mL ιωδιούχο προπίδιο και αναλύθηκαν με μικροσκοπία φθορισμού.
2.7. Ανοσοφθορισμός
Τα κύτταρα σπάρθηκαν σε γυάλινες καλυπτρίδες σε μια πλάκα 12 φρεατίων και επιμολύνθηκαν με το υποδεικνυόμενο πλασμίδιο για 24 ώρες. Στη συνέχεια, τα κύτταρα υποβλήθηκαν σε επεξεργασία με ή χωρίς αντιδραστήρια βλάβης του DNA σύμφωνα με την πειραματική διάταξη. Τα κύτταρα σταθεροποιήθηκαν σε 4% παραφορμαλδεΰδη (PFA) σε PBS για 20 λεπτά σε RT και στη συνέχεια διαπερατήθηκαν σε 0,5% Triton X-100 για 10 λεπτά. Τα πλακίδια μπλοκαρίστηκαν σε 5% φυσιολογικό ορό κατσίκας (NGS) και επωάστηκαν με πρωτογενή αντισώματα αραιωμένα σε 1% NGS όλη τη νύχτα στους 4 °C. Τα δείγματα στη συνέχεια επωάστηκαν με τα υποδεικνυόμενα δευτερεύοντα αντισώματα επισημασμένα με Alexa Fluor 488 ή 555 (Invitrogen) αραιωμένο σε 1% NGS σε RT για 1 ώρα. Στη συνέχεια, χρωματίστηκαν με DAPI για 15 λεπτά σε RT. Τα καλύμματα τοποθετήθηκαν χρησιμοποιώντας μέσο στήριξης Dako Fluorescence Mounting Medium (Agilent) και απεικονίστηκαν χρησιμοποιώντας ένα συνεστιακό μικροσκόπιο Nikon (Eclipse C1 Plus).
2.8. Ανάλυση του ανασυνδυασμού V(D)J
Εν συντομία, το πλασμίδιο αναφοράς V(D)J περιέχει ανεστραμμένο-GFP και IRES που οδηγεί σε συνεχή εκφραζόμενη RFP. Το RFP που εκφράζεται συνεχώς είναι ο έλεγχος εσωτερικής επιμόλυνσης. Αφού το γονίδιο ενεργοποίησης ανασυνδυασμού 1/2 (RAG1/2) συν-μορφομετατραπεί στα κύτταρα, το RAG1/2 θα κόψει το RSS και θα διαμεσολαβήσει την επαγωγή των DSBs, εάν συμβεί ανασυνδυασμός V(D)J, τα ανεστραμμένα GFP συνδέονται με θετική σειρά με NHEJ επισκευή. Τότε το κελί θα εκφράσει λειτουργικό GFP. Έτσι, τα διπλά θετικά κύτταρα GFP και RFP είναι η ανάγνωση της ανάλυσης αναφοράς V(D)J [ 18]. Κύτταρα 293Τ σε συρροή 70% επιμολύνθηκαν με τον V(D)J GFP reporter μόνο (υπόβαθρο) ή σε συνδυασμό με κατασκευές έκφρασης RAG1 και RAG2, σε αναλογία 1 μg V(D)J αναφοράς GFP: 0,5 μg RAG1: 0,5 μg RAG2. Την επόμενη ημέρα, το μέσο άλλαξε και μετά από επιπλέον 48 ώρες, τα κύτταρα συλλέχθηκαν και αναλύθηκαν με κυτταρομετρία ροής για έκφραση GFP και RFP.
2.9. Στατιστική ανάλυση
Όλα τα πειράματα επαναλήφθηκαν τουλάχιστον τρεις φορές χρησιμοποιώντας ανεξάρτητα συλλεχθέντα ή παρασκευασμένα δείγματα. Τα δεδομένα αναλύθηκαν με τη δοκιμή Student's t ή ANOVA ακολουθούμενη από δοκιμές πολλαπλής σύγκρισης του Tukey χρησιμοποιώντας το GraphPad 8.
3. Αποτελέσματα
3.1. Επίδραση των πυρηνικών-τοπικοποιημένων ιικών πρωτεϊνών SARS-CoV-2 στην αποκατάσταση της βλάβης του DNA
Η αποκατάσταση της βλάβης του DNA συμβαίνει κυρίως στον πυρήνα για να διασφαλιστεί η σταθερότητα του γονιδιώματος. Αν και οι πρωτεΐνες SARS-CoV-2 συντίθενται στο κυτταρόπλασμα [ 1 ], ορισμένες ιικές πρωτεΐνες είναι επίσης ανιχνεύσιμες στον πυρήνα, συμπεριλαμβανομένων των Nsp1, Nsp5, Nsp9, Nsp13, Nsp14 και Nsp16 [ 19 ]. Ερευνήσαμε εάν αυτές οι πυρηνικά εντοπισμένες πρωτεΐνες SARS-CoV-2 επηρεάζουν το σύστημα επιδιόρθωσης βλάβης του DNA του κυττάρου ξενιστή. Για αυτό, κατασκευάσαμε αυτά τα πλασμίδια έκφρασης ιικών πρωτεϊνών μαζί με πλασμίδια έκφρασης ακίδας και νουκλεοπρωτεϊνών, τα οποία γενικά θεωρούνται πρωτεΐνες εντοπισμένες σε κυτταρόπλασμα. Επιβεβαιώσαμε την έκφραση και τον εντοπισμό τους με ανοσοστύπωση και ανοσοφθορισμό ( Εικόνα 1 Α και Εικόνα S1A ). Τα αποτελέσματά μας ήταν συνεπή με αυτά από προηγούμενες μελέτες [19 ]; Οι πρωτεΐνες Nsp1, Nsp5, Nsp9, Nsp13, Nsp14 και Nsp16 είναι πράγματι εντοπισμένες στον πυρήνα και οι νουκλεοπρωτεΐνες εντοπίζονται κυρίως στο κυτταρόπλασμα. Παραδόξως, βρήκαμε την αφθονία της πρωτεΐνης ακίδας στον πυρήνα ( Εικόνα 1 Α). Η επισκευή NHEJ και ο ομόλογος ανασυνδυασμός (HR) είναι δύο κύριες οδοί επιδιόρθωσης του DNA που όχι μόνο παρακολουθούν συνεχώς και διασφαλίζουν την ακεραιότητα του γονιδιώματος αλλά είναι επίσης ζωτικής σημασίας για τις προσαρμοστικές λειτουργίες του ανοσοποιητικού κυττάρου [ 9 ]. Για να αξιολογήσουμε εάν αυτές οι ιικές πρωτεΐνες εμποδίζουν την οδό επιδιόρθωσης του DSB, εξετάσαμε την επιδιόρθωση ενός DSB ειδικού θέσης που προκαλείται από την ενδονουκλεάση I-SceI χρησιμοποιώντας την πρωτεΐνη άμεσης επανάληψης-πράσινου φθορισμού (DR-GFP) και την ολική-NHEJ-GFP ( EJ5–GFP) συστήματα αναφοράς για HR και NHEJ, αντίστοιχα [ 15 , 16]. Η υπερέκφραση των πρωτεϊνών Nsp1, Nsp5, Nsp13, Nsp14 και ακίδας μείωσε την αποτελεσματικότητα τόσο της επισκευής HR όσο και της NHEJ ( Εικόνα 1 B–E και Εικόνα S2A,B ). Επιπλέον, βρήκαμε επίσης ότι η υπερέκφραση των Nsp1, Nsp5, Nsp13 και Nsp14 κατέστειλε δραματικά τον πολλαπλασιασμό σε σύγκριση με άλλες πρωτεΐνες που μελετήθηκαν ( Εικόνα S3A,B ). Ως εκ τούτου, η ανασταλτική επίδραση των Nsp1, Nsp5, Nsp13 και Nsp14 στην αποκατάσταση της βλάβης του DNA μπορεί να οφείλεται σε δευτερογενείς επιδράσεις, όπως η διακοπή της ανάπτυξης και ο κυτταρικός θάνατος. Είναι ενδιαφέρον ότι η υπερεκφρασμένη πρωτεΐνη ακίδας δεν επηρέασε τη μορφολογία ή τον πολλαπλασιασμό των κυττάρων, αλλά κατέστειλε σημαντικά την επιδιόρθωση τόσο του HR όσο και του NHEJ ( Εικόνα 1 B–E, Εικόνες S2A,B και S3A,B ).
Εικόνα 1. Επίδραση πυρηνικών εντοπισμένων πρωτεϊνών κοροναϊού 2 (SARS–CoV–2) με σοβαρό οξύ αναπνευστικό σύνδρομο στην επιδιόρθωση βλάβης του DNA. ( Α ) Υποκυτταρική κατανομή των πρωτεϊνών SARS–CoV–2. Ο ανοσοφθορισμός πραγματοποιήθηκε στις 24 ώρες μετά τη διαμόλυνση του πλασμιδίου που εκφράζει τις ιικές πρωτεΐνες σε κύτταρα ΗΕΚ293Τ. Μπάρα κλίμακας: 10 μm. ( B ) Σχηματική απεικόνιση του ανταποκριτή EJ5-GFP που χρησιμοποιείται για την παρακολούθηση της μη ομόλογης σύνδεσης άκρου (NHEJ). ( Γ ) Επίδραση του κενού φορέα (EV) και των πρωτεϊνών SARS-CoV-2 στην επιδιόρθωση του NHEJ DNA. Οι τιμές αντιπροσωπεύουν τη μέση ± τυπική απόκλιση (SD) από τρία ανεξάρτητα πειράματα (βλέπε αντιπροσωπευτικές γραφικές παραστάσεις FACS στο Σχήμα S2A ). ( Δ) Σχηματική απεικόνιση του ανταποκριτή DR-GFP που χρησιμοποιείται για την παρακολούθηση του ομόλογου ανασυνδυασμού (HR). ( Ε ) Επίδραση των πρωτεϊνών EV και SARS-CoV-2 στην επιδιόρθωση του HR DNA. Οι τιμές αντιπροσωπεύουν τη μέση ± SD από τρία ανεξάρτητα πειράματα (βλέπε αντιπροσωπευτικές γραφικές παραστάσεις FACS στο Σχήμα S2B ). Οι τιμές αντιπροσωπεύουν τη μέση τιμή ± SD, η = 3. Η στατιστική σημασία προσδιορίστηκε χρησιμοποιώντας μονόδρομη ανάλυση διακύμανσης (ANOVA) στο ( C , E ). ** p < 0,01, *** p < 0,001, **** p < 0,0001.
3.2. Η πρωτεΐνη SARS–CoV–2 Spike αναστέλλει την αποκατάσταση της βλάβης του DNA
Επειδή οι πρωτεΐνες ακίδας είναι κρίσιμες για τη μεσολάβηση της εισόδου του ιού στα κύτταρα ξενιστές και αποτελούν το επίκεντρο των περισσότερων στρατηγικών εμβολίων [ 20 , 21 ], διερευνήσαμε περαιτέρω τον ρόλο των πρωτεϊνών αιχμής στην επιδιόρθωση βλάβης του DNA και τον σχετικό ανασυνδυασμό V(D)J. Οι πρωτεΐνες αιχμής συνήθως πιστεύεται ότι συντίθενται στο τραχύ ενδοπλασματικό δίκτυο (ER) [ 1 ]. Μετά από μεταμεταφραστικές τροποποιήσεις όπως η γλυκοζυλίωση, οι πρωτεΐνες ακίδας διακινούνται μέσω της συσκευής της κυτταρικής μεμβράνης μαζί με άλλες ιικές πρωτεΐνες για να σχηματίσουν το ώριμο ιοσωμάτιο [ 1 ]. Η πρωτεΐνη Spike περιέχει δύο κύριες υπομονάδες, S1 και S2, καθώς και αρκετούς λειτουργικούς τομείς ή επαναλήψεις [ 22 ] ( Εικόνα 2ΕΝΑ). Στη φυσική κατάσταση, οι πρωτεΐνες ακίδας υπάρχουν ως ανενεργές πρωτεΐνες πλήρους μήκους. Κατά τη διάρκεια της ιογενούς μόλυνσης, οι πρωτεάσες του κυττάρου ξενιστή, όπως η πρωτεάση της φουρίνης, ενεργοποιούν την πρωτεΐνη S διασπώντας την σε υπομονάδες S1 και S2, οι οποίες είναι απαραίτητες για την είσοδο του ιού στο κύτταρο στόχο [ 23 ]. Εξερευνήσαμε περαιτέρω διαφορετικές υπομονάδες της πρωτεΐνης ακίδας για να διασαφηνίσουμε τα λειτουργικά χαρακτηριστικά που απαιτούνται για την αναστολή επιδιόρθωσης του DNA. Μόνο η πρωτεΐνη ακίδας πλήρους μήκους ανέστειλε έντονα την επιδιόρθωση τόσο του NHEJ όσο και του HR ( Εικόνα 2 B–E και Εικόνα S4A,B). Στη συνέχεια, προσπαθήσαμε να προσδιορίσουμε εάν η πρωτεΐνη ακίδας συμβάλλει άμεσα στη γονιδιωματική αστάθεια αναστέλλοντας την επιδιόρθωση του DSB. Παρακολουθήσαμε τα επίπεδα των DSB χρησιμοποιώντας αναλύσεις κομητών. Μετά από διαφορετικές θεραπείες βλάβης του DNA, όπως η ακτινοβολία γ, η θεραπεία με δοξορουβικίνη και η θεραπεία με H 2 O 2 , υπάρχει λιγότερη επιδιόρθωση παρουσία της πρωτεΐνης ακίδας ( Εικόνα 2 F, G). Μαζί, αυτά τα δεδομένα δείχνουν ότι η πρωτεΐνη ακίδας επηρεάζει άμεσα την επιδιόρθωση του DNA στον πυρήνα.
Εικόνα 2. Η πρωτεΐνη ακίδας του κορωνοϊού 2 (SARS–CoV–2) με σοβαρό οξύ αναπνευστικό σύνδρομο αναστέλλει την αποκατάσταση της βλάβης του DNA. ( Α ) Σχηματική της πρωτογενούς δομής της πρωτεΐνης ακίδας SARS–CoV–2. Η υπομονάδα S1 περιλαμβάνει μια Ν-τελική περιοχή (NTD, 14-305 υπολείμματα) και μια περιοχή δέσμευσης υποδοχέα (RBD, 319-541 υπολείμματα). Η υπομονάδα S2 αποτελείται από το πεπτίδιο σύντηξης (FP, 788-806 υπολείμματα), την αλληλουχία επανάληψης επταπεπτιδίου 1 (HR1, 912-984 υπολείμματα), HR2 (1163-1213 υπολείμματα), περιοχή ΤΜ (TM, 1213-1237 υπολείμματα) και τομέας κυτταροπλάσματος (CT, 1237-1273 κατάλοιπα). ( Β , Γ ) Επίδραση της τιτλοδοτημένης έκφρασης της πρωτεΐνης ακίδας στην επιδιόρθωση του DNA σε κύτταρα HEK-293T. ( Δ , Ε) Μόνο η πρωτεΐνη ακίδας πλήρους μήκους αναστέλλει την επιδιόρθωση του DNA της μη ομόλογης σύνδεσης άκρου (NHEJ) και του ομόλογου ανασυνδυασμού (HR). Οι τιμές αντιπροσωπεύουν τη μέση τιμή ± SD από τρία ανεξάρτητα πειράματα (βλέπε αντιπροσωπευτικές γραφικές παραστάσεις FACS στο Σχήμα S4A,B ). ( ΣΤ ) Κύτταρα HEK293T που έχουν διαμολυνθεί με πρωτεΐνες πλήρους μήκους ακίδας (S-FL) εμφάνισαν μεγαλύτερη βλάβη στο DNA από κενά κύτταρα που είχαν διαμολυνθεί με φορέα, S1- και S2 υπό διαφορετικές συνθήκες βλάβης του DNA. Για δοξορουβικίνη: 4 μg/mL, 2 ώρες. Για γ–ακτινοβολία: 10 Gy, 30 min. Για H 2 O 2 : 100 μΜ, 1 h. Μπάρα κλίμακας: 50 μm. ( Ζ ) Αντίστοιχη ποσοτικοποίηση των ροπών της ουράς του κομήτη από 20 διαφορετικά πεδία με n> 200 κομήτες τριών ανεξάρτητων πειραμάτων. Η στατιστική σημασία αξιολογήθηκε χρησιμοποιώντας μια αμφίδρομη ανάλυση διακύμανσης (ANOVA). NS (Μη σημαντικό): * p > 0,05, ** p < 0,01, *** p < 0,001, **** p < 0,0001.
3.3. Οι πρωτεΐνες Spike εμποδίζουν τη στρατολόγηση πρωτεϊνών σημείων ελέγχου επιδιόρθωσης ζημιών DNA
Για να επιβεβαιώσουμε την ύπαρξη πρωτεΐνης ακίδας στον πυρήνα, πραγματοποιήσαμε ανάλυση υποκυτταρικού κλάσματος και διαπιστώσαμε ότι οι πρωτεΐνες ακίδας δεν είναι μόνο εμπλουτισμένες στο κλάσμα της κυτταρικής μεμβράνης αλλά είναι επίσης άφθονες στο πυρηνικό κλάσμα, με ανιχνεύσιμη έκφραση ακόμη και στο κλάσμα που συνδέεται με τη χρωματίνη ( Εικόνα 3 Α). Παρατηρήσαμε επίσης ότι η ακίδα έχει τρεις διαφορετικές μορφές, η υψηλότερη ζώνη είναι μια άκρως γλυκοζυλιωμένη ακίδα, η μεσαία είναι μια ακίδα πλήρους μήκους και η κάτω είναι μια υπομονάδα ακίδας με σχισμή. Σε συμφωνία με τον προσδιορισμό κομήτη, βρήκαμε επίσης την ανοδική ρύθμιση του δείκτη βλάβης του DNA, γ-H2A.X, σε κύτταρα υπερεκφρασμένα από πρωτεΐνες ακίδας υπό συνθήκες βλάβης του DNA ( Εικόνα 3 Β). Μια πρόσφατη μελέτη πρότεινε ότι οι πρωτεΐνες αιχμής προκαλούν στρες ER και αποικοδόμηση πρωτεϊνών που σχετίζεται με το ER [24 ]. Για να αποκλείσουμε την πιθανότητα ότι η πρωτεΐνη ακίδας αναστέλλει την επιδιόρθωση του DNA προάγοντας την αποικοδόμηση της πρωτεΐνης επιδιόρθωσης του DNA, ελέγξαμε την έκφραση ορισμένων βασικών πρωτεϊνών επιδιόρθωσης DNA στα μονοπάτια επιδιόρθωσης NHEJ και HR και βρήκαμε ότι αυτές οι πρωτεΐνες επιδιόρθωσης DNA ήταν σταθερές μετά από υπερέκφραση πρωτεΐνης ακίδας ( Εικόνα 3 ΝΤΟ). Για να προσδιορίσουμε πώς η πρωτεΐνη ακίδας αναστέλλει τις οδούς επιδιόρθωσης NHEJ και HR, αναλύσαμε τη στρατολόγηση των BRCA1 και 53BP1, οι οποίες είναι οι βασικές πρωτεΐνες του σημείου ελέγχου για την επισκευή HR και NHEJ, αντίστοιχα. Βρήκαμε ότι η πρωτεΐνη ακίδας ανέστειλε σημαντικά τον σχηματισμό εστιών BRCA1 και 53BP1 ( Εικόνα 3 D-G). Μαζί, αυτά τα δεδομένα δείχνουν ότι η πρωτεΐνη ακίδας πλήρους μήκους SARS-CoV-2 αναστέλλει την επιδιόρθωση βλάβης στο DNA παρεμποδίζοντας τη στρατολόγηση πρωτεϊνών επισκευής DNA.
Εικόνα 3. Η πρωτεΐνη ακίδας του κορωνοϊού 2 (SARS–CoV–2) με σοβαρό οξύ αναπνευστικό σύνδρομο εμποδίζει τη στρατολόγηση πρωτεϊνών σημείου ελέγχου επιδιόρθωσης βλάβης του DNA. ( Α ) Το κλάσμα μεμβράνης (MF), το κυτοσολικό κλάσμα (CF), το διαλυτό πυρηνικό κλάσμα (SNF) και το κλάσμα δεσμευμένο στη χρωματίνη (CBF) από κύτταρα HEK293T που επιμολύνθηκαν με πρωτεΐνη ακίδας SARS-CoV-2 ανοσοστυπώθηκαν για ακίδα His-tag και ενδεικνυόμενες πρωτεΐνες. ( B ) Αριστερά: Ανοσοκηλίδες του δείκτη βλάβης DNA γH2AX σε κενό φορέα (EV) – και πρωτεΐνη ακίδας – που εκφράζουν κύτταρα HEK293T μετά από ακτινοβολία γ 10 Gy. Δεξιά: αντίστοιχος ποσοτικός προσδιορισμός των ανοσοκηλίδων στα αριστερά. Οι τιμές αντιπροσωπεύουν τη μέση τιμή ± SD ( n = 3). Η στατιστική σημασία προσδιορίστηκε χρησιμοποιώντας το Student's t- test. **** σελ < 0,0001. ( Γ ) Ανοσοκηλιδώματα βλάβης του DNA επιδιορθώνουν τις σχετικές πρωτεΐνες σε κύτταρα HEK293T που εκφράζουν πρωτεΐνη ακίδας. ( D ) Αντιπροσωπευτικές εικόνες σχηματισμού εστιών 53BP1 σε κύτταρα HEK293 που εκφράζουν πρωτεΐνες EV- και ακίδα που εκτίθενται σε ακτινοβολία γ 10 Gy. Μπάρα κλίμακας: 10 μm. ( Ε ) Ποσοτική ανάλυση εστιών 53BP1 ανά πυρήνα. Οι τιμές αντιπροσωπεύουν τη μέση τιμή ± SEM, n = 50. ( F ) Σχηματισμός εστιών BRCA1 σε κενά κύτταρα HEK293 που εκφράζουν πρωτεΐνες ακίδας και φορέα που εκτίθενται σε ακτινοβολία γ 10 Gy. Μπάρα κλίμακας: 10 μm. ( G ). Ποσοτική ανάλυση εστιών BRCA1 ανά πυρήνα. Οι τιμές αντιπροσωπεύουν τη μέση τιμή ± SEM, n = 50. Η στατιστική σημασία προσδιορίστηκε χρησιμοποιώντας Student's t-δοκιμή. **** p < 0,0001.
3.4. Η πρωτεΐνη Spike επηρεάζει τον ανασυνδυασμό V(D)J In vitro
Η αποκατάσταση της βλάβης του DNA, ειδικά η επιδιόρθωση του NHEJ, είναι απαραίτητη για τον ανασυνδυασμό V(D)J, ο οποίος βρίσκεται στον πυρήνα της ανοσίας των Β και Τ κυττάρων [ 9 ]. Μέχρι σήμερα, πολλά εγκεκριμένα εμβόλια SARS–CoV–2, όπως τα εμβόλια mRNA και τα εμβόλια αδενοϊού–COVID–19, έχουν αναπτυχθεί με βάση την πρωτεΐνη ακίδας πλήρους μήκους [ 25 ]. Αν και είναι αμφισβητήσιμο εάν το SARS-CoV-2 μολύνει άμεσα πρόδρομες ενώσεις λεμφοκυττάρων [ 26 , 27 ], ορισμένες αναφορές έχουν δείξει ότι τα μολυσμένα κύτταρα εκκρίνουν εξωσώματα που μπορούν να μεταφέρουν RNA ή πρωτεΐνη SARS-CoV-2 στα κύτταρα στόχους [ 28 , 29]. Δοκιμάσαμε περαιτέρω εάν η πρωτεΐνη ακίδας μείωσε τον ανασυνδυασμό V(D)J που προκαλείται από NHEJ. Για αυτό, σχεδιάσαμε ένα in vitro σύστημα αναφοράς ανασυνδυασμού V(D)J σύμφωνα με μια προηγούμενη μελέτη [ 18 ] ( Εικόνα S5 ). Σε σύγκριση με τον κενό φορέα, η υπερέκφραση της πρωτεΐνης ακίδας ανέστειλε τον ανασυνδυασμό V(D)J με τη μεσολάβηση RAG σε αυτό το in vitro σύστημα αναφοράς ( Εικόνα 4 ).
Σχήμα 4. Η πρωτεΐνη Spike επηρεάζει τον ανασυνδυασμό V(D)J in vitro. ( A ) Σχηματική απεικόνιση του συστήματος αναφοράς V(D)J. ( Β ) Αντιπροσωπευτικά γραφήματα κυτταρομετρίας ροής δείχνουν ότι η πρωτεΐνη ακίδας SARS–CoV–2 εμποδίζει τον ανασυνδυασμό V(D)J in vitro. ( Γ ) Ποσοτική ανάλυση του σχετικού ανασυνδυασμού V(D)J. Οι τιμές αντιπροσωπεύουν τη μέση τιμή ± SD, η = 3. Η στατιστική σημασία προσδιορίστηκε χρησιμοποιώντας το Student's t- test. **** p < 0,0001.
4. Συζήτηση
Τα ευρήματά μας παρέχουν ενδείξεις ότι η πρωτεΐνη ακίδας πειράζει τον μηχανισμό επιδιόρθωσης βλάβης του DNA και τον προσαρμοστικό ανοσοποιητικό μηχανισμό in vitro. Προτείνουμε έναν πιθανό μηχανισμό με τον οποίο οι πρωτεΐνες ακίδας μπορεί να βλάψουν την προσαρμοστική ανοσία αναστέλλοντας την επιδιόρθωση βλάβης του DNA. Αν και δεν έχουν δημοσιευθεί στοιχεία ότι ο SARS-CoV-2 μπορεί να μολύνει θυμοκύτταρα ή λεμφοειδή κύτταρα μυελού των οστών, η in vitro δοκιμασία αναφοράς V(D)J δείχνει ότι η πρωτεΐνη ακίδας εμπόδισε έντονα τον ανασυνδυασμό V(D)J. Σύμφωνα με τα αποτελέσματά μας, οι κλινικές παρατηρήσεις δείχνουν επίσης ότι ο κίνδυνος σοβαρής ασθένειας ή θανάτου με COVID-19 αυξάνεται με την ηλικία, ειδικά οι ηλικιωμένοι ενήλικες που διατρέχουν τον υψηλότερο κίνδυνο [ 22]. Αυτό μπορεί να οφείλεται στο ότι οι πρωτεΐνες ακίδας SARS–CoV–2 μπορούν να αποδυναμώσουν το σύστημα επιδιόρθωσης DNA των ηλικιωμένων και κατά συνέπεια να εμποδίσουν τον ανασυνδυασμό V(D)J και την προσαρμοστική ανοσία. Αντίθετα, τα δεδομένα μας παρέχουν πολύτιμες λεπτομέρειες σχετικά με τη συμμετοχή των υπομονάδων πρωτεΐνης ακίδας στην επιδιόρθωση βλάβης του DNA, υποδεικνύοντας ότι τα εμβόλια πλήρους μήκους που βασίζονται σε ακίδα μπορεί να αναστείλουν τον ανασυνδυασμό του V(D)J στα Β κύτταρα, κάτι που είναι επίσης σύμφωνο με ένα πρόσφατο μελέτη ότι ένα εμβόλιο πλήρους μήκους που βασίζεται σε ακίδα προκάλεσε χαμηλότερους τίτλους αντισωμάτων σε σύγκριση με το εμβόλιο με βάση το RBD [ 28]. Αυτό υποδηλώνει ότι η χρήση αντιγονικών επιτόπων της ακίδας ως εμβόλιο SARS–CoV–2 μπορεί να είναι ασφαλέστερη και πιο αποτελεσματική από την ακίδα πλήρους μήκους. Συνολικά, εντοπίσαμε έναν από τους δυνητικά σημαντικούς μηχανισμούς καταστολής του SARS-CoV-2 του προσαρμοστικού ανοσοποιητικού μηχανισμού του ξενιστή. Επιπλέον, τα ευρήματά μας υποδηλώνουν επίσης μια πιθανή παρενέργεια του εμβολίου πλήρους μήκους με βάση την ακίδα. Αυτή η εργασία θα βελτιώσει την κατανόηση της παθογένεσης του COVID-19 και θα παράσχει νέες στρατηγικές για το σχεδιασμό πιο αποτελεσματικών και ασφαλέστερων εμβολίων.
Συμπληρωματικά Υλικά
Τα ακόλουθα είναι διαθέσιμα στο διαδίκτυο στη διεύθυνση https://www.mdpi.com/article/10.3390/v13102056/s1 , Εικόνα S1: Έκφραση πυρηνικών εντοπισμένων πρωτεϊνών SARS–CoV–2 σε ανθρώπινα κύτταρα, Εικόνα S2: Επίδραση πυρηνικού SARS– Οι πρωτεΐνες CoV-2 στο μονοπάτι επιδιόρθωσης NHEJ– και HR–DNA, Εικόνα S3: Τα Nsp1, Nsp5, Nsp13, Nsp14 αλλά όχι η ακίδα αναστέλλουν τον κυτταρικό πολλαπλασιασμό, Εικόνα S4: Επίδραση μεταλλαγμάτων ακίδας SARS–CoV–2 στο NHEJ– και HR– DNA μονοπάτι επισκευής, Εικόνα S5: In vitro προσδιορισμός ανασυνδυασμού V(D)J.
Συνεισφορές Συγγραφέων
Ο HJ συνέλαβε και σχεδίασε τη μελέτη. Οι HJ και Y.-FM επέβλεψαν τη μελέτη, πραγματοποίησαν πειράματα και ερμήνευσαν τα δεδομένα. Γράψιμο—προετοιμασία πρωτότυπου σχεδίου, HJ; Γράψιμο — κριτική και επεξεργασία, HJ και Y.-FM. εξαγορά χρηματοδότησης, Y.-FM Όλοι οι συγγραφείς έχουν διαβάσει και έχουν συμφωνήσει με τη δημοσιευμένη έκδοση του χειρογράφου.
Χρηματοδότηση
Αυτή η εργασία υποστηρίχθηκε από επιχορηγήσεις προγραμματισμού της Ιατρικής Σχολής του Πανεπιστημίου Umeå για τον COVID–19 (αριθμός ερευνητικού έργου: 3453 16032 στο YFM). το Lion's Cancer Research Foundation στο Πανεπιστήμιο Umeå (επιχορηγήσεις: LP 17–2153, AMP 19–982 και LP 20–2256 στο YFM) και τα κονδύλια ALF της μονάδας βάσης για έρευνα σε ακαδημαϊκές μονάδες υγειονομικής περίθαλψης και πανεπιστημιακές μονάδες υγειονομικής περίθαλψης στο βόρειο τμήμα της υγειονομικής περίθαλψης περιοχή (ALF–Basenheten: 2019, 2020, 2021 προς YFM).
Δήλωση του Συμβουλίου Θεσμικής Αναθεώρησης
Δεν ισχύει, λόγω αυτής της μελέτης που δεν αφορά ανθρώπους ή ζώα.
Δήλωση Ενημερωμένης Συναίνεσης
Δεν ισχύει, λόγω αυτής της μελέτης που δεν αφορά ανθρώπους.
Δήλωση διαθεσιμότητας δεδομένων
Τα δεδομένα που παρουσιάζονται σε αυτή τη μελέτη είναι διαθέσιμα στο κύριο κείμενο και στο Συμπληρωματικό Υλικό .
Συγκρούσεις συμφερόντων
Οι συγγραφείς έχουν δηλώσει ότι δεν υπάρχουν ανταγωνιστικά συμφέροντα. Οι χρηματοδότες δεν είχαν κανένα ρόλο στο σχεδιασμό της μελέτης, στη συλλογή και ανάλυση δεδομένων, στην απόφαση για δημοσίευση ή στην προετοιμασία του χειρογράφου.



































.jfif)











.jpg)


































































































..webp)




















































































.jpg)






























































































.jpg)





























































































.jpg)







































































